Proktologie II – die Behandlung des akuten Analschmerzes
D. Wilhelm, U. Nitsche
Kommt ein Patient mit akuten analen Schmerzen zum Arzt…
Wir haben im ersten Teil dieser Abhandlung bereits die proktologische Diagnostik abgehandelt und hierbei die Bedeutung der proktologischen Anamnese hervorgehoben, die es bei sorgfältiger Durchführung in einer Vielzahl der Fälle erlaubt, die Diagnose zu stellen, bzw. die möglichen Ursachen auf eine enge Auswahl einzuschränken. Aus diesem Grund und als Anleitung für die Praxis haben wir uns daher dazu entschieden, die proktologische Therapie anhand der Beschwerden, mit denen der Patient sich in der Klinik oder Praxis vorstellt, zu unterteilen.
Starker, akut einsetzender Schmerz
Die häufigsten Ursachen für eine schmerzbedingte Vorstellung beim Proktologen sind die Analvenenthrombose und die Analfissur. Beide Erkrankungen resultieren typischerweise nach einer erschwerten Defäkation mit starkem Pressen (Analvenenthrombose) oder bei Obstipation aufgrund einer harten Stuhlkonsistenz (Analfissur).
Die häufigsten Ursachen des akuten analen Schmerzes sind die Analvenenthrombose und die Analfissur
Beide Schmerzen werden als epikritisch charakterisiert, das heißt, sie sind von intensivem Charakter und klar lokalisierbar. Während die Analvenenthrombose eine im Verlauf über Tage langsam abnehmende Intensität aufweist, ist der Schmerz bei analer Fissur im Stundenverlauf abnehmend, wird aber durch jede weitere Stuhlpassage erneut initiiert und wird meist als wesentlich intensiver angegeben. Differentialdiagnostisch kommen ein inkazerierter Analprolaps und eine thrombosierte Hämorrhoide in Frage, die jedoch tendentiell weniger Schmerzen machen. Auch anale Abszesse sind gelegentlich Grund eines analen Schmerzes, entwickeln sich in der Regel aber langsam und sind von dumpfer Natur. Darüber hinaus müssen neuropathische Schmerzen berücksichtigt werden, etwa im Rahmen einer Herpes Infektion oder funktionelle Störungen wie bei der Proktalgia fugax.
| Tabelle 1: Häufige Ursachen für anale Schmerzen |
|---|
| Analvenenthrombose |
| Analfissur |
| Hämorrhoiden (Prolaps/Thrombose) |
| Abszess/Entzündung (Proktitis) |
| Funktionelle Störungen |
| Neuropathische Störungen |
Analvenenthrombose
Die Analvenenthrombose ist Folge eines Thrombus in den venösen Geflechten des Plexus ani externus (Abb. 1) und somit im Bereich des Anoderms lokalisiert. 1 Man unterscheidet den isolierten Thrombus von multiplen perianalen Thrombosen, wie sie häufiger in der Schwangerschaft zu finden sind. Die Diagnose ist leicht und mittels Inspektion der Analregion zu stellen. Der sichtbare Thrombus ist druckschmerzhaft und meist von praller Konsistenz und von Anoderm überzogen. Differentialdiagnostisch muss eine thrombosierte Hämorrhoide und ein inkarzerierter Analprolaps unterschieden werden, wobei die Abgrenzung einer thrombosierten Hämorrhoide auch erfahrenen Kollegen mitunter schwer fällt. Wir empfehlen daher bei Unklarheit eine Proktoskopie und Abgrenzung des Hämorrhoidalkomplexes.
Die Therapie der Analvenenthrombose orientiert sich am zeitlichen Verlauf und dem Ausmaß der Beschwerden.
Für die Therapie ist der Zeitpunkt der Diagnosestellung entscheidend. Mit zunehmender zeitlicher Distanz zwischen Entstehung und Vorstellung beim Arzt kommt es zu einer Organisation des Thrombus, der eine Entlastung durch Inzision erschwert. Daher sollte eine Inzision nur innerhalb der ersten Tage erfolgen, wobei der ideale cut-off zwischen 1 und 3-4 Tage liegt 2. Daher sollte neben der zeitlichen Korrelation die Beschwerdesymptomatik der Patienten berücksichtigt werden und mögliche Komorbiditäten (Antikoagulatien). Es muss hierbei nochmals auf die Empfindlichkeit des Anoderms hingewiesen werden und die Gefahr der Schädigung dieses wichtigen sensiblen Bereiches durch unsachgemäße Maßnahmen.
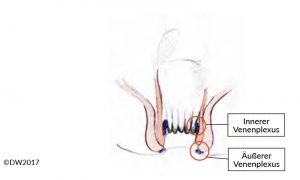
Abb.: 1 Schematische Darstellung des Analkanals mit Markierung des internen (Hämorrhoidalplexus) und externen Venenplexus
Für die Inzision wird die betroffene Region mit Lokalanaesthetika infiltriert und sodann über der Thrombose radial zum Anus spindelförmig exzidiert. In den meisten Fällen prolabiert der Thrombus spontan oder kann mit leichtem Druck ausmassiert werden. Bei bereits stattgefundener Organisation sollte eine übermäßige Manipulation vermeiden werden. Bei etwaiger Blutungsneigung sollte die Inzision mit einer Naht (resorbierbares Nahtmaterial, Stärke 3-0/4-0) verschlossen werden, dies kann aber ansonsten unterbleiben. Die Aufklärung des Patienten sollte neben dem Hinweis auf die schmerzhafte Infiltration/Anaesthesie, auch die meist harmlose postinterventionelle geringe Blutungsneigung beinhalten. Allergische Dispositionen gegenüber Lokalanaesthetika und eine Blutungsneigungen sollten ausgeschlossen werden. Die weitere Therapie umfasst Analgetika und eventuell Sitzbäder.
Unbehandelt heilen Analvenenthrombosen in der Regel innerhalb von 2-3 Wochen ab, so dass bei der per se gutartigen Erkrankung keine chirurgische Therapie erforderlich ist. Bei konservativer Therapie haben sich lokale Anaesthetika und NSAIR zur Schmerzlinderung bewährt, zudem wurde ein positiver Effekt von Glycerintrinitrat und Nifedipin Salbe beschrieben. Im eigenen Vorgehen hat sich zudem die Schonung und Beckenhochlagerung bewährt, die zu einer raschen Abschwellung führt. Ergänzend können Stuhlweichmacher und hygienische Maßnahmen empfohlen werden 3.
Eine 2009 publizierte Studie analysiert das konservative Vorgehen in 72 Patienten und fand 13.9% Rezidive bei gutem Ansprechen der vorgeschlagenen Therapie 4.
Eine Übersichtsarbeit die 2013 veröffentlicht wurde und verschiedene Therapieformen vergleicht kommt trotz mangelhafter Datenlage zu dem Schluss dass nach Exzision und chirurgischer Entlastung eine signifikant schneller Symptomfreiheit erreicht wird und die Rezidivraten klar gesenkt werden können (ca. 5%), allerdings in einem geringen Prozentsatz Abszesse und Fisteln resultieren können. 2
Analfissur
Ebenso wie die Analvenenthrombose ist die Analfissur eine Blickdiagnose (ggf. nach Einspiegeln mit dem Proktoskop) und in Kombination mit der typischen Anamnese einfach zu diagnostizieren. Für die Behandlung entscheidend ist die Unterscheidung zwischen einer akuten und chronischen Analfissur, welche sich anhand der zeitlichen Beziehung ergibt, aber auch morphologische Unterschiede aufweist. Während sich im akuten Stadium die Fissur als spaltenförmiger Einriss des Anoderms zeigt, kommt es in der Chronifizierung zu einer Hypertrophie der umgebenden Strukturen, die sich in der hypertrophen Analpapille und der Vorpostenfalte demarkieren 5 (Abb.:2). Neben dem akuten Schmerz, der nahezu regelhaft einen Analspasmus und Stuhlverhalt provoziert, finden sich häufig auch Blutungen und ggf. eine eitrige Sekretion bei begleitender Fistel. Steht kein Proktoskop (z.B. in der Ambulanz) zur Verfügung, so ist die eindeutige und gut lokalisierbare Angabe von Schmerzen bei der digital-rektalen Untersuchung diagnostisch bedeutsam.
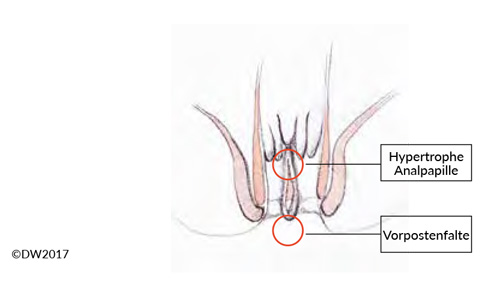
Abb.2: Die Analfissur beschreibt einen oberflächlichen Einriss der Analhaut im Analkanal. Im Rahmen der Chronifizierung bildet sich häufig eine hypertrophe Analpapille und eine Vorpostenfalte aus. Zudem kann eine Fistel zur darüber gelegenen Kryptenregion vorliegen.
Aufgrund des Leitsymptoms des akuten Schmerzes, der aufgrund des sekundären Spasmus der Analregion eine Abheilung verhindert, ist die Schmerztherapie die Grundlage der Behandlung. Neben NSAIR und lokalen Anaesthetika (Salben, Suppositorien) verlangt der ausgeprägte Schmerz häufig die lokale Infiltrationsbehandlung. Hierzu sollte die betroffene Region mit einer feinen Kanüle und unter Verwendung eines mittel- bis langwirksamen Anaesthetikums unterspritzt werden. Zudem empfiehlt sich die Applikation sphinkterentspannender Externa, wie etwa Nitrosalbe, oder Kalziumkanalblocker in Form von Diltiazem- oder Nifedipinsalbe. 6 Da reizende Substanzen im Stuhl die Symptomatik aggravieren können, sollte der Patient auf entsprechende diätetische Maßnahmen hingewiesen werden, explizit der Vermeidung von Kaffee, Zitrusfrüchten und scharfen Gewürzen. Auch entspannende Sitzbäder können zur Linderung der Beschwerden beitragen.
Bei ausgeprägter Analspastik (klinische Bewertung) gewinnt zudem die Entspannung des Sphinkterapparates an Bedeutung. Dies kann zum einen in Form einer Sphinkterdehnung erreicht werden, welche vor allem durch Selbstdilatation mittels Kegel erfolgen kann. Zudem sollte bereits bei der Diagnosestellung, insofern der Patient dies aufgrund einer Untersuchung in Sedierung zulässt, eine manuelle Dehnung erfolgen. Diese ist jedoch schonend und adaptiert duchzuführen, eine ekzessive Dehnung wie von Lord beschrieben sollte unterbleiben. 7 Eine Alternative stellt die Injektion von Botulinomtoxin dar 8, die eine längeranhaltende Sphinkterschwächung erreichen kann, und bei der 2-3 Injektionen fissurnah lateral der Linea anocutanea in den M. sphincter ani externus erfolgen sollten (20-50IU). Die Ergebnisse nach Botox-Injektion sind, eine entsprechende Selektion der Patienten vorausgesetzt, gut mit Rezidivraten um 10-30% und einer Schmerzfreiheit um 80% nach 1 Woche 6,9.
Eine operative Therapie ist indiziert, wenn komplizierende Faktoren bestehen, die ein Abheilen unter konservativer Therapie verhindern. Hierzu zählen begleitende Fistel, eine ausgeprägte Sklerosierung der Fissurregion und eine Vorpostenfalte, die eine Retention von Stuhl in der Fissur bedingt. Die zudem häufig aufgeführte hypertrophe Analpapille ist nach eigener Einschätzung Hinweis auf eine Beteiligung der Kryptenregion und auf das Vorliegen einer möglichen Fistel 10.
Entsprechend muss die operative Therapie die komplette Evakuation des Analkanals sicherstellen, d.h. einen ungehinderte Passage des Stuhls ohne Retention gewährleisten. Insofern verlangt die Fissurektomie eine weite Excision der Fissurregion bis weit nach external und jenseits der Linea anocutanea. Letzteres ist sowohl Mittel zum Erfolg, aber auch Grund für die postoperativen Schmerzen, auf die der Patient hingewiesen werden muss.
Die Fissurektomie ist nicht die Heilung der Fissur, sondern die Grundlage eines mindestens 2-3 Wochen dauernden Heilungsverlaufs
Wir resezieren bei der Fissurektomie standardmäßig die proximal gelegene Analpapille und die angrenzende Kryptenregion, auch um mögliche submuköse Fisteln zu entfernen (eine zuvorige, vorsichtige Sondierung der Fissur und Kryptenregion ist empfohlen). Die Exzision sollte unter Schonung der Sphinktermuskulatur und sorgfältig durchgeführt werden (Abb.3). Bei starker Sklerosierung des Fissurgrundes ist ein Anfrischen, etwa durch schonenden Einsatzes eines scharfen Löffels, erforderlich. Auch sollte eine kontrollierte Sphinkterdehnung Bestandteil jeder Fissurektomie sein, kann in Narkose aber gut durchgeführt werden. Aufgrund der zu erwartenden postoperativen Schmerzen infiltrieren wir standardmäßig noch intraoperativ die betroffene Region mit einem langwirksamen Anaesthetikum.
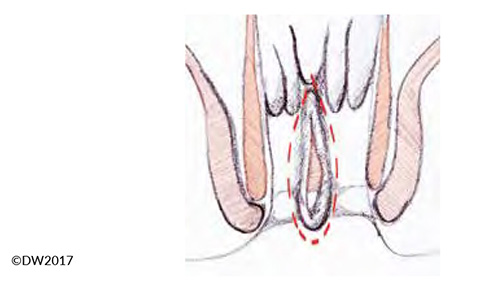
Abb.3: Ausmaß der Fissurektomie welche bis weit nach external geführt werden sollte, um eine Retention von Stuhl zu vermeiden.
Die früher empfohlene laterale Sphinkterotomie, die die Senkung des überhöhten Sphinktertonus zum Ziel hatte, sollte unseres Erachtens nach nicht mehr erfolgen, da sie zum einen das Risiko einer Inkontinenz beinhaltet 11 und in Form der Botolinuminjektion heute gute Alternativen verfügbar sind. 9
Die Erfolgsraten nach Fissurektomie liegen bei 95% und sind als sehr gut zu bewerten 12,13. Ursache für ein Rezidiv sind meist die unzureichende Excision nach extern und ein vorzeitiges Verkleben der Wundränder, weswegen eine entsprechende Kontrolle in den ersten Wochen empfohlen wird.
Thrombosierte Hämorrhoide
Auch die Thrombose einer Hämorrhoide kann Grund für eine akute anale Schmerzsymptomatik sein, wobei nicht der externe venöse Plexus betroffen ist, sondern die Geflechte des Plexus ani internus. 14 Die Differentialdiagnose zur Perianalvenenthrombose, vor allem bei Vorliegen von dritt- oder viertgradigen Hämorrhoiden, die am Analkanal sichtbar sind, ist mitunter schwierig, kann aber aufgrund der glänzenden Analhaut und dem proktoskopischen Bezug zum Hämorrhoidalkomplex meist eindeutig gestellt werden (Abb. 4). Prinzipiell entspricht die Therapie der Behandlung der Analvenenthrombose, wobei wir aufgrund der höheren Blutungsneigung eher ein konservatives Vorgehen empfehlen und nur im akuten Stadium (Schmerzereignis <24h) und ausgeprägter Symptomatik eine Entlastung vornehmen. Bezüglich der Vorgehensweise verweisen wir auf die obige Abhandlung. Auch die konservative Therapie entspricht dem Vorgehen bei der Analvenenthrombose, wobei wir eine Reposition der betroffenen Hämorrhoiden nach intraanal und eine konsequente Entlastung und Beckenhochlagerung empfehlen.
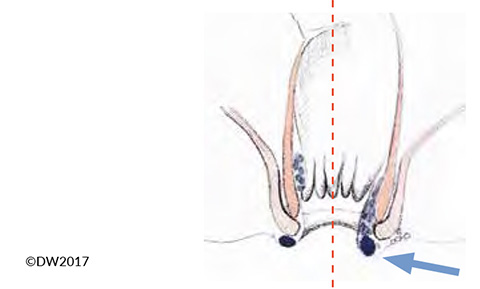
Abb.4: Bei Vorliegen einer Hämorhoidalprolapses (Pfeil) fällt die Unterscheidung zwischen thrombosierter Analvene (links) und Hämorrhoide (rechts) mitunter schwer.
Inkarzerierter Hämorrhoidalknoten/-prolaps
Neben der Thrombose kann auch eine Inkarzeration einer Hämorrhoide akute Schmerzen verursachen, der meist weniger stark empfunden wird und vor allem bei einem partiellen oder kompletten Analprolaps vorzufinden ist. Es findet sich hierbei eine diffuse Schwellung des betroffenen Knotens, welcher keine lokale, prallelastische Einblutung wie bei der Thrombose aufweist.
Soweit möglich sollte der inkarzerierte Knoten im akuten Stadium sanft reponiert werden und kann ggf. mit einem Analtampon oder einer aufgerollten Kompresse retendiert werden. Bei der Reposition sind ausreichende Zeit und ein schonendes Vorgehen wichtig, erneut kann eine Beckenhochlagerung und lokale Kühlung unterstützend eingesetzt werden. Nach erfolgreicher Reposition empfehlen wir den Patienten den Knoten für weitere 15-30min reponiert zu halten (Vorlage einer Kompresse in Beckenhochlagerung), um ein Abschwellen des Knotens zu erreichen.
In seltenen Fällen misslingt die Reposition und erfordert das operative Vorgehen. Aufgrund der akuten Schwellung besteht hierbei die Gefahr einer übermäßigen Resektion, weswegen diese nur von einem erfahrenen Proktologen durchgeführt werden sollte. 1 Eine Resektion sollte immer nach erfolgreicher Reposition angedacht werden, kann dann aber elektiv nach 2-3 Tagen erfolgen.
Bezüglich des operativen Vorgehens verweisen wir auf den Folgebeitrag zur analen Blutung, welcher die Behandlung von Hämorrhoiden beinhaltet.
Perianaler Abszess
Aufgrund ihrer raumwirkenden Ausdehnung und lokalen Inflammation finden sich auch bei perianalen Abszessen Schmerzen in der Anal- und Perianalregion die je nach Lage klar lokalisiert werden können (oberflächlicher Abszess) oder als dumpf drückend (tiefer, mitunter supralevatorischer Abszess) empfunden werden. Die Diagnose ist bei oberflächlicher Abszedierung einfach und aufgrund der lokalisierten Rötung, Schwellung und Überwärmung zu stellen, kann bei tiefer Lage aber durchaus anspruchsvoll sein. Wichtig ist es, v.a. bei auch nur gering erhöhten Entzündungszeichen daran zu denken. Bei vermeintlich tiefer Lage sollte daher zudem eine Rektoskopie und Endosonografie erfolgen, bei nicht-Verfügbarkeit reicht häufig aber auch der transkutane Ultraschall, welcher auch für die Diagnose pelviner Prozesse geeignet ist. Die Notwendigkeit für ein MRT sehen wir nur in Ausnahmefällen, bei Rezidiv oder komplexem Fistelleiden hingegen sollte es großzügig durchgeführt werden.
Die Therapie besteht entsprechend dem chirurgischen Grundsatz „ubi pus, ibi evacua“ in der operativen Abszesspaltung und Drainage. Alleinige Inzisionen nach lokaler Anaesthesie hingegen rezidivieren nahezu regelhaft und sollten nur in Ausnahmefällen durchgeführt werden. Die operative Revision beinhaltet stets die proktoskopische Exploration des Rektums und den Ausschluss einer begleitenden Fistel. Wir empfehlen die großzügige spindelförmige Inzision die radiär zum Anus und mit ausreichendem Abstand zum Anus und unter Schonung der Sphinkteren durchgeführt werden sollte. Bei großen, konfluierenden Abszessen (z.B. Hufeisenabszess) sollte eine Gegeninzision und Drainageneinlage erfolgen. Eine postoperative Antibiose ist bei suffizienter Drainage entbehrlich, sollte aber bei begleitender Phlegmone diskutiert werden. Misslingt die Fisteldarstellung intraoperativ (diese sollte auch nicht forciert werden) ist eine proktologische Untersuchung im Verlauf und nach Rückgang der begleitenden Schwellung empfohlen. Auf die explizite Diagnose und Therapie von Fisteln werden wir in einem gesonderten Beitrag Stellung nehmen.
Neuropathische Schmerzen/Funktionelle Beschwerden
Auch diverse neurogene Ursachen können einen akuten analen Schmerz provozieren, wobei sich zum Teil weitere pathologische Befunde ergeben, die zur Diagnosestellung genutzt werden können, bzw. lässt die Schmerzcharakteristik eine weitere Differenzierung zu.
Bei genitaler Manifestation einer Herpesinfektion kann es im Verlauf der Erkrankung neben Brennen und Juckreiz, auch zu mitunter starken Schmerzen kommen. Diese finden sich vor allem bei rektalem Befall in Form einer viralen Proktitis. Die Diagnosestellung ist aufgrund der typischen Effloreszenzen (flüssigkeitsgefüllte Bläschen) einfach und kann durch einen Abstrich oder einen Antikörpernachweis im Blut gesichert werden. Bei starken Schmerzen sollte immer auch die Proktoskopie mit durchgeführt werden. Für die Therapie empfiehlt sich eine orale Virustase mit z.B. Aciclovir, Valaciclovir, oder Famciclovir. 15
Die Proktalgia fugax ist charakterisiert durch plötzlich einsetzende Schmerzen perineal und rektal, die einen z.T. sehr intensiven Charakter aufweisen und einige Sekunden bis maximal 30min andauern. Die Schmerzen sind nicht mit der Defäkation korreliert und die Patienten zwischen den Anfällen beschwerdefrei. Die Diagnose ergibt sich aus der typischen Anamnese und nach Ausschluss konkurrierender Ursachen. Die Genese ist noch nicht hinreichend geklärt, vermutet werden Muskelspasmen der Analregion. Eine spezifische Therapie existiert nicht, symptomatisch können systemische Analgetika (z.B. Novaminsulfon) verabreicht werden. 16,17
Das Levator ani Syndrom ist eine weitere funktionelle Störung die durch einen Spasmus des M. levator ani gekennzeichnet ist und die sich durch entsprechende Schmerzen manifestiert. 18 Die Beschwerden dauern in der Regel länger als 30min an und werden beim Sitzen aggraviert. Die Diagnose ist klinisch und liegt im Nachweis einer persistierenden Anspannung des M. levator ani bei der digital rektalen Untersuchung. Häufig findet sich zudem eine Dyssynergie der Beckenbodenmuskulatur und ein Sphinkterspasmus. Eine Defäkografie kann dem erfahrenen Untersucher ggf. ebenfalls hinweisend sein. Die Therapie erfasst warme Sitzbäder, muskelrelaxierende Medikamente, anale Massage und ein Biofeedbacktraining. Letzteres kann die Beschwerden in über 80% therapieren und ist daher die Therapie der Wahl. 19
Dem Levator ani Syndrom verwandt ist der sogenannte Anismus, ein chronischer Spasmus des Schmließmuskels, welcher zur kontinuierlichen Schmerzen führt und zu einer Obstruktion im Sinne einer outlet obstruction. 20 Die Diagnose ist klinisch und analmanometrisch zu stellen, wobei bereits bei der digitalen Untersuchung der deutlich erhöhte Sphinktertonus und die fehlende Relaxierung beim Pressen auffällt. Die Diagnostik sollte konkurrierende Ursachen (v.a. Fissur) ausschließen, die Therapie umfasst muskelentspannende Salben (Nitrosalbe, Diltiazem und Nifedipin) und die Injektion von Botox, welches eine bis zu 3 Monate dauernde Senkung des Muskeltonus erreicht.21 Auch das Biofeedback hat bei dieser Erkrankung eine relevante Bedeutung.
Zusammenfassung
Akute anale Schmerzen sind eine häufige Ursache für die Konsultation eines Proktologen und Endoskopikers. In der Regel findet sich eine Analvenenthrombose oder Analfissur, oder eine Erkrankung des Hämorrhoidalkomplexes. Auch Entzündungen und Abszesse führen zu Schmerzen, haben in der Regel aber einen leichteren und langsam zunehmenden Charakter. Seltener liegen funktionelle Störungen oder neuropathische Alterationen vor. Die Behandlung umfasst konservative Maßnahmen wie Analgetika und entspannende Substanzen und die operative Therapie.
Literatur
- Hardy A, Cohen CR. The acute management of haemorrhoids. Annals of the Royal College of Surgeons of England 2014;96:508-11.
- Chan KK, Arthur JD. External haemorrhoidal thrombosis: evidence for current management. Techniques in coloproctology 2013;17:21-5.
- Greenspon J, Williams SB, Young HA, Orkin BA. Thrombosed external hemorrhoids: outcome after conservative or surgical management. Diseases of the colon and rectum 2004;47:1493-8.
- Gebbensleben O, Hilger Y, Rohde H. Do we at all need surgery to treat thrombosed external hemorrhoids? Results of a prospective cohort study. Clinical and experimental gastroenterology 2009;2:69-74.
- Heitland W. [Perianal fistula and anal fissure]. Der Chirurg; Zeitschrift fur alle Gebiete der operativen Medizen 2012;83:1033-9.
- Nelson RL, Thomas K, Morgan J, Jones A. Non surgical therapy for anal fissure. The Cochrane database of systematic reviews 2012:CD003431.
- O’Connor JJ. Lord procedure for treatment of postpartum hemorrhoids and fissures. Obstetrics and gynecology 1980;55:747-8.
- Simms HN, McCallion K, Wallace W, Campbell WJ, Calvert H, Moorehead RJ. Efficacy of botulinum toxin in chronic anal fissure. Irish journal of medical science 2004;173:188-90.
- Chen HL, Woo XB, Wang HS, et al. Botulinum toxin injection versus lateral internal sphincterotomy for chronic anal fissure: a meta-analysis of randomized control trials. Techniques in coloproctology 2014;18:693-8.
- Herzig DO, Lu KC. Anal fissure. The Surgical clinics of North America 2010;90:33-44, Table of Contents.
- Hasse C, Brune M, Bachmann S, Lorenz W, Rothmund M, Sitter H. [Lateral, partial sphincter myotomy as therapy of chronic anal fissue. Long-term outcome of an epidemiological cohort study]. Der Chirurg; Zeitschrift fur alle Gebiete der operativen Medizen 2004;75:160-7.
- Abramowitz L, Bouchard D, Souffran M, et al. Sphincter-sparing anal-fissure surgery: a 1-year prospective, observational, multicentre study of fissurectomy with anoplasty. Colorectal disease : the official journal of the Association of Coloproctology of Great Britain and Ireland 2013;15:359-67.
- Aigner F, Conrad F. Fissurectomy for treatment of chronic anal fissures. Diseases of the colon and rectum 2008;51:1163; author reply 4.
- Lohsiriwat V. Anorectal emergencies. World journal of gastroenterology 2016;22:5867-78.
- Wienert V. [Virus-induced anorectal diseases. Condylomata acuminata and herpes simplex]. Der Hautarzt; Zeitschrift fur Dermatologie, Venerologie, und verwandte Gebiete 2004;55:248-53.
- Rao SS, Bharucha AE, Chiarioni G, et al. Functional Anorectal Disorders. Gastroenterology 2016.
- Jeyarajah S, Chow A, Ziprin P, Tilney H, Purkayastha S. Proctalgia fugax, an evidence-based management pathway. International journal of colorectal disease 2010;25:1037-46.
- Grant SR, Salvati EP, Rubin RJ. Levator syndrome: an analysis of 316 cases. Diseases of the colon and rectum 1975;18:161-3.
- Chiarioni G, Nardo A, Vantini I, Romito A, Whitehead WE. Biofeedback is superior to electrogalvanic stimulation and massage for treatment of levator ani syndrome. Gastroenterology 2010;138:1321-9.
- Andromanakos N, Skandalakis P, Troupis T, Filippou D. Constipation of anorectal outlet obstruction: pathophysiology, evaluation and management. Journal of gastroenterology and hepatology 2006;21:638-46.
- Emile SH, Elfeki HA, Elbanna HG, et al. Efficacy and safety of botulinum toxin in treatment of anismus: A systematic review. World journal of gastrointestinal pharmacology and therapeutics 2016;7:453-62.


