IMPN: Fukuoka Einteilung (Guidelines)
Siegbert Faiss, Berlin
Guidelines in der Diagnostik und Therapie intraduktal papillärer muzinöser Neoplasien des Pankreas (IPMN)
Zystische Tumoren des Pankreas werden zunehmend diagnostiziert. Die exakte Zuordnung dieser vielfältigen Tumoren zu einer bestimmten Entität und deren Abgrenzung gegenüber nicht neoplastischen zystischen Läsionen des Pankreas (z.B. Pseudozysten) fällt oftmals schwer. Im besonderen Fokus stehen dabei – nicht nur wegen ihrer Häufigkeit – die intraduktalen papillären Neoplasien des Pankreas (IPMN). Diese Tumoren besitzen ein bestimmtes malignes Potential und können somit als Präkanzerosen des Pankreas eingestuft werden. Dies führt zu einer nicht endenden Diskussion um deren Therapienotwendigkeit, die von Beobachten über die begrenzte chirurgische Resektion bis hin zur vollständigen Pankreatektomie reicht. Seit 2006 versuchen verschiedene Guidelines (2006 Sendai-Kriterien (1); 2012 Fukuoka Guidelines (2)) mehr oder weniger klare Diagnostik- und Therapieempfehlungen für die IPMN abzugeben, die sich initial fast ausschließlich an der Größe der zystischen Läsion und deren Beteiligung am Pankreashauptgang und/oder an den Pankreasseitengängen orientierte. Seit 2017 sind nunmehr die revidierten Fukuoka Guidelines für diese Tumoren der aktuelle Diagnose- und Therapiestandard (3).
In diesen revidierten Fukuoka Guidelines wird zwischen Fukuoka positiven IPMN mit Hochrisiko-Stigmata, IPMN mit sog. „worrisome-features“ und Fukuoka negativen IPMN unterschieden.
Fukuoka positive IPMN:
Fukuoka positive IPMN sind IPMN mit Hochrisiko-Stigmata für ein Malignom. Hierzu gehören IPMN
- des Pankreaskopfes die zu einem obstruktiven Ikterus geführt haben
- mit einem Kontrastmittelaufnehmenden muralen Knötchen ?5mm
- mit einer Erweiterung des Pankreashauptganges auf ?10mm (sog. Hauptgang-IPMN)
IPMN mit „worrisome features“:
IPMN mit Fukuoka „worrisome features“ sind IPMN mit
- zystischen Läsionen ?3cm
- verdickten/Kontrastmittelaufnehmenden Zystenwänden
- Erweiterung des Pankreashauptganges auf 5-9mm
- abrupter Änderung der Pankreasgangweite und distaler Atrophie
- Lymphknotennachweis
- erhöhten CA 19-9 Serum-Werten
- Zystenwachstum um mindestens 5mm in 2 Jahren
- Klinisches Vorliegen einer Pankreatitis
Fukuoka negative IPMN:
Fukuoka negative IPMN sind IPMN ohne die genannten Hochrisiko-Stigmata und ohne die genannten „worrisome features“.
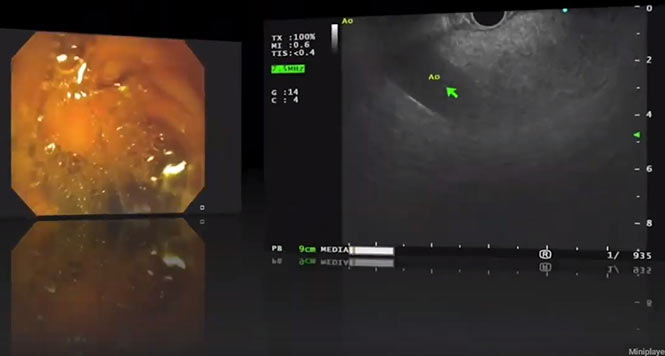
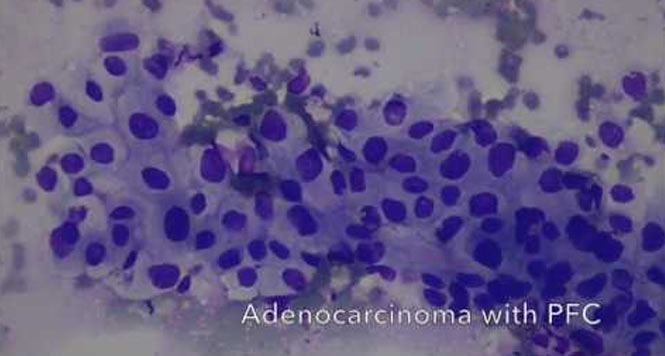
Aus den genannten Kriterien dieser Guidelines ist ersichtlich, dass die Einteilung der IPMN nicht mehr nur nach deren Größe und/oder nach Haupt- oder Seitengangsbeteiligung erfolgt, sondern hoch differenziert vorgenommen werden muss. Kriterien wie z.B. kontrastmittelaufnehmende murale Knötchen von < oder ?5mm Größe können zuverlässig eigentlich nur mit einer hochauflösenden Endosonographie unter dem Einsatz eines Ultraschallkontrastmittels (CH-EUS) und weniger genau mit der MRT bestimmt werden (s. Abb. 1–5).
Die Guidelines geben auch Empfehlungen zum therapeutischen Vorgehen ab. Fukuoka positive IPMN sollten bei operablen Patienten operiert werden. Beim Vorliegen von „worrisome features“ und dem Nachweis muraler Knötchen ?5mm in der Endosonographie, dem Nachweis von Hauptgangsveränderungen oder dem Vorliegen einer malignomsuspekten oder gar malignen Zytologie sollte ebenfalls eine chir. Resektion angestrebt werden. Ist dies alles nicht der Fall, so sollten entsprechend der Größe des IPMN Kontrollen mittels CT/MRT bzw. EUS in gewissen Abständen erfolgen. Abb. 6 gibt einen Überblick über das diagnostische und therapeutische Vorgehen bei IPMN analog der revidierten Fukouka Guidelines (3).
Ein Vorgehen entsprechend diesen Guidelines hat gezeigt, dass das Risiko einer Übertherapie „harmloser“ IPMN durch eine nicht gerechtfertigte Operation und gleichzeitig das Auftreten maligner Tumoren aus scheinbar „harmlosen“ IPMN als sehr gering einzustufen ist. In einer Untersuchung an über 1100 Patienten mit einem IPMN zeigte sich, dass das Auftreten eines Malignoms bei Fukuoka negativen IPMNs innerhalb von 5 Jahren bei unter 2% liegt. Beim Vorliegen von „worrisome features“ liegt das Karzinom Risiko bei nicht operierten IPMNs bei ca. 4% während bei Fukuoka positiven Patienten innerhalb von 5 Jahren bei 49% ein Pankreaskarzinom nachgewiesen werden konnte (4).
Bei der Überwachung von Patienten mit einem IPMN sollte unbedingt beachtet werden, dass Malignome des Pankreas auch außerhalb und unabhängig von den zystischen Läsionen gehäuft auftreten können (5). Daher sollte die Überwachung immer das gesamte Pankreas mit einschließen.






Literatur:
- Tanaka M, Chari S, Adsay V, Fernandez-del Castillo C, Falconi M, Shimizu M, et al. ‘International consensus guidelines for management of intraductal papillary mucinous neoplasms and mucinous cystic neoplasms of the pancreas’. Pancreatology 2006; 6: 17–32.
- Tanaka M, Fernandez-del Castillo C, Adsay V, Chari S, Falconi M, Jang JY, et al. ‘International consensus guidelines 2012 for the management of IPMN and MCN of the pancreas’, Pancreatology 2012; 12: 183–97.
- Tanaka M, Fernandez-del Castillo C, Kamisawa T, Jang JY, Levy P, Ohtsuka T, et al. ‘Revisions of international consensus Fukuoka guidelines for the management of IPMN of the pancreas’, Pancreatology 2017; 17 :738–53.
- Mukewar S, de Pretis N, Aryal-Khanal A, Ahmed A, Sah R, Enders F, Larson JJ, et al. ‘Fukuoka criteria accurately predict risk for adverse outcomes during follow-up of pancreatic cysts presumed to be intraductal papillary mucinous neoplasms’, Gut 2017 Oct; 66(10): 1811–17.
- Yamaguchi K, Kanemitsu S, Hatori T, Maguchi H, Shimizu Y, Tada M, et al.
‘Pancreatic ductal adenocarcinoma derived from IPMN and pancreatic ductal adenocarcinoma concomitant with IPMN’, Pancreas 2011; 40: 571–80.